膜性腎病(Membranous Nephropathy, MN)被稱為成人腎病綜合征的“頭號元兇”,在我國成人原發性腎病綜合征中占比達20%-30%。約30%-40%的患者會在5-15年內進展為終末期腎病,最終面臨透析或腎移植的命運[1]。MN可分為原發性膜性腎病(PMN)和繼發性膜性腎病(SMN),其中PMN占比更大。
膜性腎病的診斷和治療曾長期面臨挑戰,直到2009年,抗磷脂酶A2受體(PLA2R)抗體的發現,為MN的診斷帶來了突破。血清中PLA2R抗體檢測,已被納入2021年《KDIGO腎小球疾病臨床實踐指南》,成為膜性腎病診斷的重要依據[2-3]。
然而臨床實踐發現,傳統ELISA方法(酶聯免疫吸附測定法)檢測PLA2R抗體的靈敏度有限,存在漏檢風險;且PLA2R-IgG(抗磷脂酶A2受體抗體IgG)無法克服狼瘡性腎炎等繼發性膜性腎病的干擾。我國科研人員通過生物標志物研究發現,PLA2R-IgG的亞型PLA2R-IgG4,在輔助診斷MN,以及鑒別PMN與SMN中,展現出顯著優勢。這一成果為PMN的精準診療開辟了新方向,推動臨床診療向個體化、無創化方向持續邁進。
膜性腎病:成人腎病綜合征的“頭號元兇”
膜性腎病是一種以腎小球毛細血管壁免疫復合物沉積為特征的原發性腎小球疾病。患者通常表現為:
大量蛋白尿:24小時尿蛋白定量>3.5g
低蛋白血癥:血清白蛋白<30g/L
水腫:多從眼瞼、面部開始,逐漸累及全身
高脂血癥:膽固醇和甘油三酯水平升高
更令人擔憂的是,膜性腎病患者的血栓栓塞風險顯著增加,發生率可達7%-37%[4],嚴重威脅患者生命安全。
傳統診斷困境:腎活檢的“兩難抉擇”
長期以來,膜性腎病的確診主要依賴腎穿刺活檢這一“金標準”。然而,腎活檢作為有創性檢查,存在諸多局限:
風險與并發癥
? 出血風險:約1%-2%的患者可能出現嚴重出血
? 感染風險:穿刺部位感染概率約0.1%-0.2%
? 患者恐懼心理:創傷性檢查導致部分患者拒絕或延誤診斷
診斷局限性
? 僅能提供“快照式”病理信息,無法動態監測病情變化
? 無法預測治療反應性和疾病預后
? 部分患者因凝血功能異常等原因無法實施
現有血液檢測指標PLA2R-IgG,帶來的困惑
2009年,Beck等學者首次發現PLA2R是PMN的主要靶抗原[2],這一里程碑式發現徹底改變了膜性腎病的診療格局。但是,現在最常用的ELISA方法學檢測的PLA2R-IgG,也給臨床帶來了困惑[5]:
靈敏度有限
相關研究顯示,現有ELISA方法學檢測的PLA2R-IgG的靈敏度約為50%,許多檢測值處于灰區的患者,仍逃不開腎活檢病理檢查。
SMN造成結果干擾
在狼瘡性MN中,主要以IgG1-IgG3陽性為主;在腫瘤相關性MN中,主要以IgG1和IgG2陽性為主。因此PLA2R-IgG陽性的患者,無法區分PMN與SMN。
PLA2R-IgG4:膜性腎病診療的“游戲規則改變者”
PLA2R-IgG4檢測的核心價值
1.精準鑒別診斷,避免有創檢查[6-7]
? 高特異性和靈敏度:PMN中,免疫復合物沉積以IgG4為主。因此,PLA2R-IgG4在PMN診斷中的靈敏度和特異性均優于PLA2R-IgG。
? 代替腎臟活檢:血清PLA2R-IgG4水平與腎小球PLA2R染色顯著相關,血清PLA2R-IgG4濃度可替代腎臟PLA2R免疫組化診斷IMN。
? 無創檢測:提高血液檢測的精準度,進一步減少灰區患者的病理檢查。
2 預后評估,制定個體化方案[7]
? PLA2R-IgG4陰性患者在首次12個月治療中緩解率更高。
? PLA2R-IgG4/IgG比值,在預測緩解方面優于單純PLA2R-IgG4檢測。
? 基線時,低PLA2R-IgG4/IgG比值的患者更容易獲得緩解。
檢測技術優勢:精準、便捷、臨床友好
迪安診斷基于先進的時間分辨免疫分析法 (TRFIA),推出PLA2R-IgG4檢測服務,具備以下技術優勢[8]:
? 超高敏感性:檢測限可達0.02mg/L
? 寬檢測范圍:0.02-340mg/L
? 高精密度:批內變異系數3.2%,批間變異系數5.6%
? 熒光增強:熒光增強劑將原始熒光增強100萬倍
適用人群與臨床應用場景
? 腎病綜合征的鑒別診斷:特別是中老年起病者,24h尿蛋白>3.5g且病因不明者
? 膜性腎病患者的治療監測及預后判斷
? 相比于PLA2R-IgG,更好地鑒別PMN與SMN
檢測結果解讀與臨床意義
當PLA2R-IgG4結果≥200ng/ml,提示存在PLA2R相關原發性膜性腎小球腎炎,建議前往醫院腎內科進一步就診。

未來展望:精準醫學時代的腎臟病診療
PLA2R-IgG4檢測的臨床應用,標志著膜性腎病診療進入精準醫學時代。隨著檢測技術的不斷完善和新靶抗原的發現(如THSD7A、NELL1等),膜性腎病的診療將更加精準和個體化[9]。
迪安診斷始終致力于推動腎臟病精準診療技術的發展,持續推出創新的膜性腎病整體解決方案,為廣大腎臟病患者提供更加準確、便捷的診療服務。

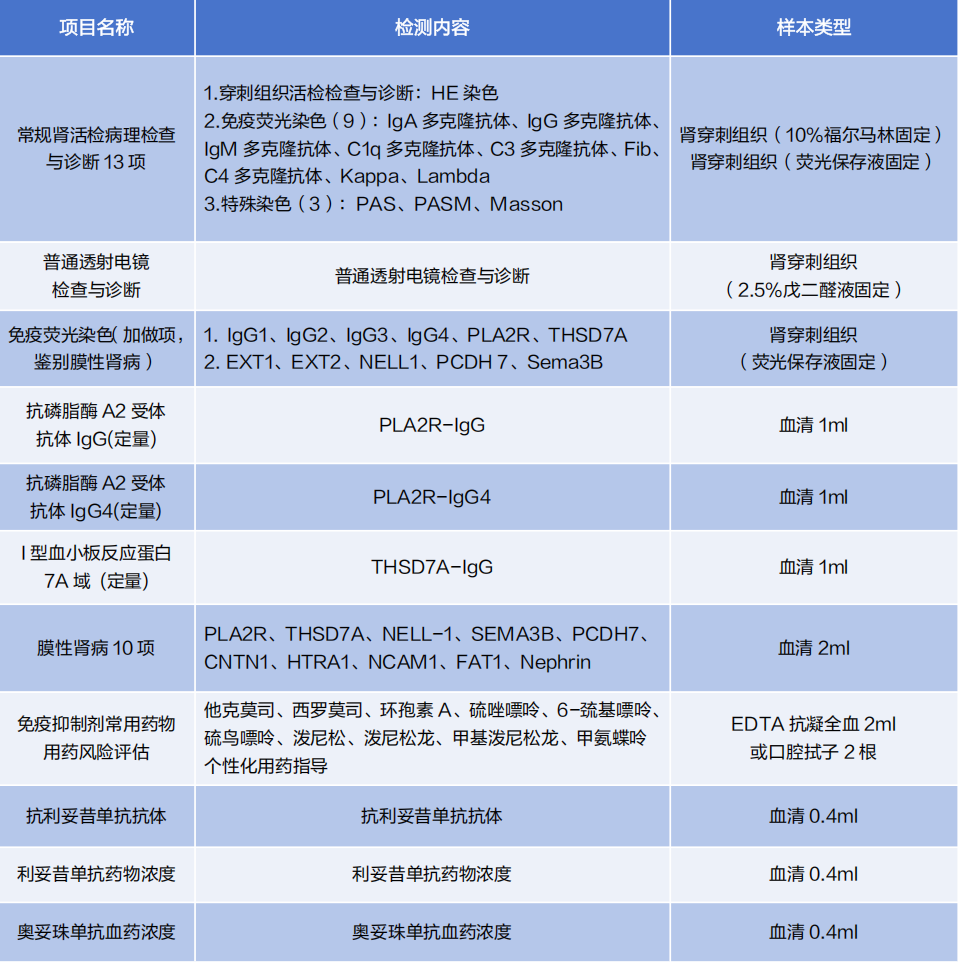
迪安診斷膜性腎病相關檢測項目
參考文獻:
[1] Couser WG. Primary membranous nephropathy. Clin J Am Soc Nephrol. 2017;12(6):983-997.
[2] Beck LH Jr, Bonegio RG, Lambeau G, Beck DM, Powell DW, Cummins TD, Klein JB, Salant DJ. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med. 2009 Jul 2;361(1):11-21.
[3] Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021 Oct;100(4S):S1-S276.
[4] Barbour SJ, Greenwald A, Djurdjev O, et al. Disease-specific risk of venous thromboembolic events is increased in idiopathic glomerulonephritis. Kidney Int. 2012;81(2):190-195.
[5] Hofstra JM, Wetzels JF. Anti-PLA?R antibodies in membranous nephropathy: ready for routine clinical practice? Neth J Med. 2012 Apr;70(3):109-13.
[6] Huang B, Zhang Y, Wang L, Xu W, Zhang J, Zhang Q, Sheng H, Hu Z. Phospholipase A2 Receptor Antibody IgG4 Subclass Improves Sensitivity and Specificity in the Diagnosis of Idiopathic Membranous Nephropathy. Kidney Blood Press Res. 2019;44(4):848-857.
[7] Zhang Y, Huang Y, Huang B, Chen X, Zhou B, Zou P, Wang L, Liu X, Sheng H, Xie M. Clinical Evaluation of Antiphospholipase A2 Receptor IgG4 level and Its IgG4-to-IgG Ratio Based on Quantitative Immunoassays in Idiopathic Membranous Nephropathy. Biomed Res Int. 2022 May 13;2022:9127520.
[8] Huang B, Wang L, Cao YN, Zhang Y, Zhang J, Xiao H, Zhang Q, Wang W, Sun Z, Chen Y, Hu Z, Sheng H. Improvement of idiopathic membranous nephropathy diagnosis with ultrasensitive quantitative detection of anti-phospholipase A2 receptor. J Allergy Clin Immunol. 2017 Jun;139(6):1988-1990.e2.
[9] Sethi S, Debiec H, Madden B, et al. Neural epidermal growth factor-like 1 protein (NELL-1) associated membranous nephropathy. Kidney Int. 2020;97(1):163-174.





